Popularny lek wycofany z obrotu. GIF wydał pilne ostrzeżenie

Główny Inspektorat Farmaceutyczny (GIF) wydał pilny komunikat dotyczący wycofania z obrotu popularnego leku stosowanego przy dolegliwościach układu pokarmowego. Decyzja ma rygor natychmiastowej wykonalności, co oznacza, że produkt musi natychmiast zniknąć z aptecznych półek w całym kraju. Powodem interwencji jest wykryta wada jakościowa, która może bezpośrednio rzutować na proces leczenia pacjentów.
- Przyczyny decyzji i wyniki badań stabilności
- Rygor natychmiastowej wykonalności i jego konsekwencje
- Instrukcja postępowania dla pacjentów
- Szczegółowe dane wycofanej partii leku
Przyczyny decyzji i wyniki badań stabilności
Decyzja o wycofaniu leku zapadła po przeprowadzeniu rutynowych badań stabilności produktu. Analizy laboratoryjne wykazały, że w 18. miesiącu przechowywania produkt przestał spełniać rygorystyczne normy jakościowe. Głównym problemem okazała się zbyt niska zawartość substancji czynnej w porównaniu do dolnego limitu określonego w oficjalnej specyfikacji leku.
Zaniżona zawartość kluczowego składnika leczniczego to poważne uchybienie. Jak informuje GIF, taka sytuacja może prowadzić do obniżonej skuteczności terapeutycznej. W praktyce oznacza to, że pacjent przyjmujący lek w celu zahamowania objawów chorobowych może nie uzyskać oczekiwanej poprawy zdrowia, co Inspektorat klasyfikuje jako potencjalne zagrożenie.
Przeczytaj też: Pilne wycofanie leku stosowanego na lęk i bezsenność. GIF ostrzega pacjentów
Rygor natychmiastowej wykonalności i jego konsekwencje
Decyzja GIF została opatrzona rygorem natychmiastowej wykonalności, co uruchamia ścisłe procedury w całym łańcuchu dostaw. Od momentu publikacji komunikatu, lek ze wskazanej serii nie może być dalej sprzedawany ani wydawany pacjentom w żadnej aptece na terenie Polski. Hurtownie oraz placówki medyczne są zobowiązane do zabezpieczenia zapasów i wycofania ich z obrotu.
Rygor ten oznacza również całkowity zakaz redystrybucji oraz dalszego wykorzystywania wadliwej partii. Dla pacjenta jest to sygnał, że bezpieczeństwo i skuteczność terapii tym konkretnym preparatem stanęły pod znakiem zapytania, a organy nadzorcze podjęły kroki mające na celu całkowite wyeliminowanie ryzyka pomyłkowego zakupu leku o obniżonej jakości.
Instrukcja postępowania dla pacjentów
Osoby, które posiadają w swoich domowych apteczkach leki na biegunkę, powinny niezwłocznie sprawdzić numer serii na boku opakowania lub bezpośrednio na blistrze. Jeśli numer zgadza się z komunikatem GIF, należy natychmiast zaprzestać stosowania preparatu. Choć wada jakościowa nie musi oznaczać bezpośredniego zagrożenia życia, zażywanie leku o osłabionym działaniu jest nieuzasadnione medycznie.
Pacjenci posiadający wadliwy produkt powinni skontaktować się z apteką, w której dokonali zakupu. Farmaceuci udzielą informacji o procedurze zwrotu lub utylizacji produktu. Warto pamiętać, że szybka reakcja pozwala uniknąć sytuacji, w której w nagłym przypadku zastosujemy lek, który nie zadziała tak, jak powinien.
Szczegółowe dane wycofanej partii leku
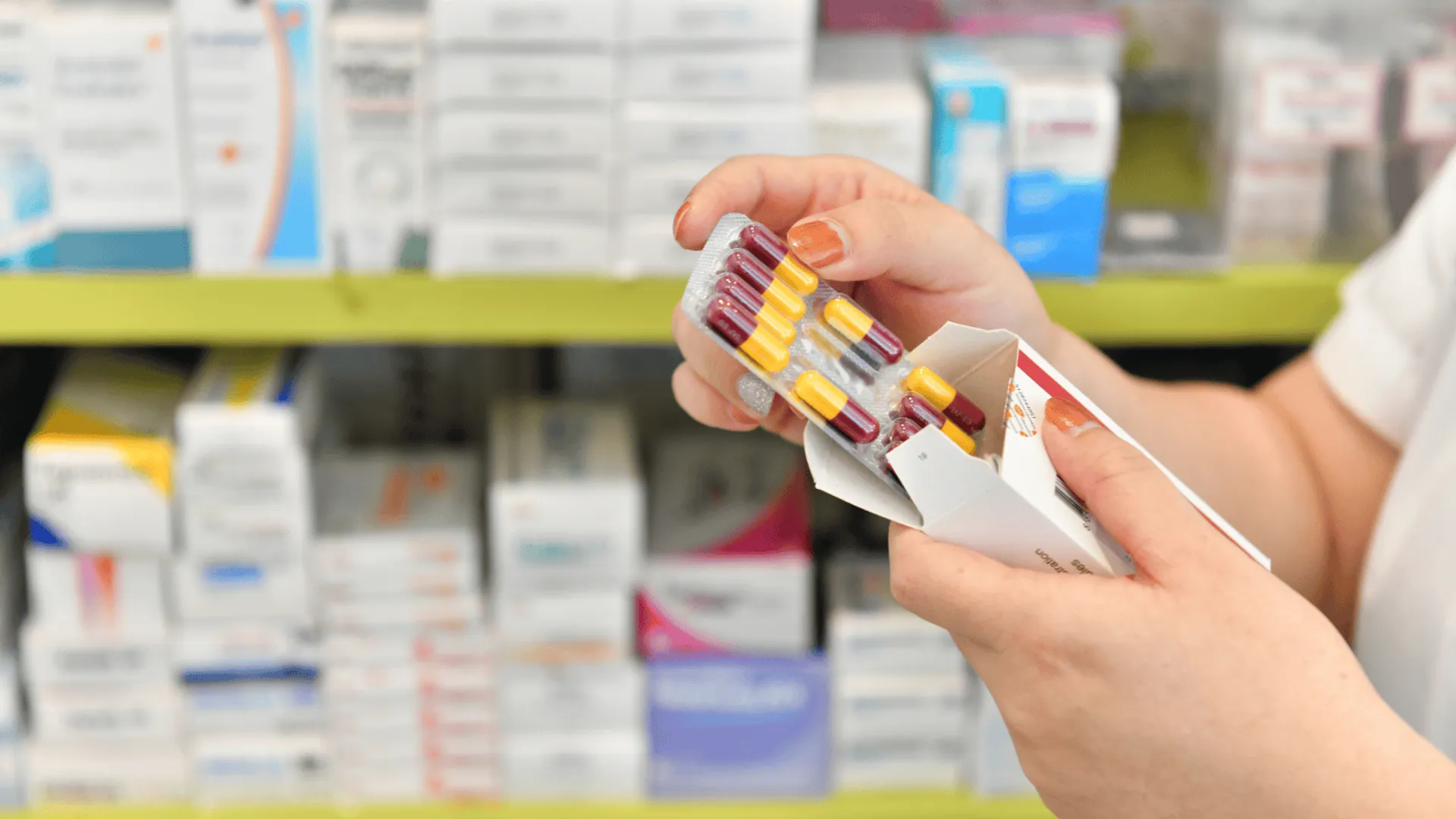
Wycofanie dotyczy konkretnej serii popularnego leku Loperamid w kapsułkach. Poniżej znajdują się dane umożliwiające precyzyjną identyfikację produktu:
- Nazwa leku: Loperamid APTEO MED
- Moc: 2 mg
- Postać: kapsułki twarde (20 sztuk)
- Numer serii: IJW024001
- Termin ważności: 31.12.2026
- Podmiot odpowiedzialny: Synoptis Pharma Sp. z o.o.
- Kod GTIN: 05909991453596
Źródło: GIF (Główny Inspektorat Farmaceutyczny)