GIF wycofuje maść do oczu w trybie pilnym! Zagraża zdrowiu pacjentów

Główny Inspektor Farmaceutyczny ogłasza wycofanie z obrotu maści z antybiotykiem z powodu stwierdzenia zanieczyszczenia substancji czynnej. Jak podaje GIF, niezidentyfikowane zanieczyszczenie stanowi realne i bezpośrednie zagrożenie dla pacjentów.
Zanieczyszczenie mikrobiologiczne w maści Dexamytrex
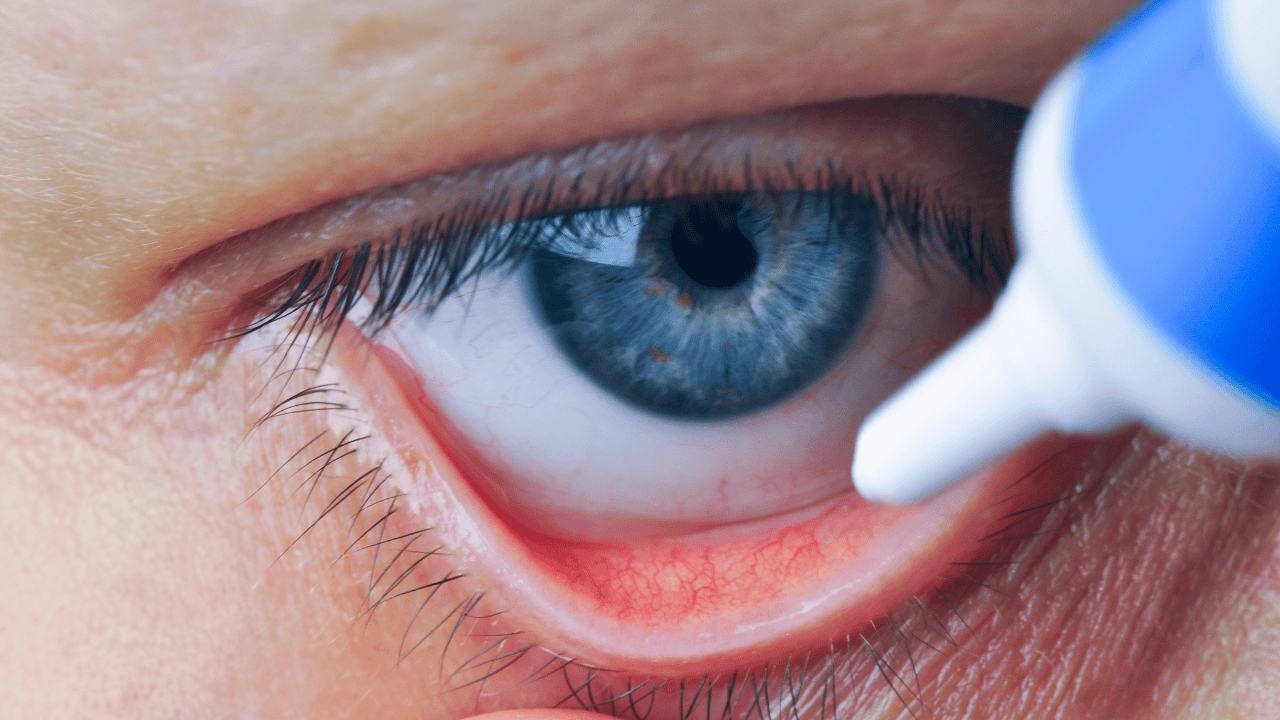
Główny Inspektor Farmaceutyczny wycofuje z obrotu na terenie całej Polski produkt leczniczy Dexamytrex. Jest to maść do oczu zawierająca dwa składniki aktywne: antybiotyk (gentamycynę) oraz lek z grupy kortykosteroidów (deksametazon). Dexamytrex stosuje się miejscowo w leczeniu bakteryjnych zakażeń oczu ze współistniejącym stanem zapalnym.
GIT otrzymał zawiadomienie od przedstawiciela podmiotu odpowiedzialnego Dr. Gerhard Mann Chem. – pharm. Fabrik GmbH, o wykryciu zanieczyszczenia mikrobiologicznego substancji czynnej (siarczanu gentamycyny).
"Niezidentyfikowane zanieczyszczenie mikrobiologiczne substancji czynnej stanowi realne i bezpośrednie zagrożenie dla pacjentów stosujących produkt leczniczy" – możemy przeczytać w uzasadnieniu decyzji.
Szczegóły dotyczące wadliwych serii leku
Dexamytrex, (Gentamicinisulfas + Dexamethasonum), (5 mg + 0,3 mg)/g, maść do oczu, opakowanie 3 g, GTIN 05909990654918 w zakresie serii:
- numer 153, termin ważności 28.02.2026;
- numer 243, termin ważności 30.04.2026;
podmiot odpowiedzialny: Dr. Gerhard Mann Chem.-Pharm. Fabrik GmbH z siedzibą w Niemczech.

Zabezpieczenie rynku krajowego
GIF informuje, że konieczne było wyeliminowanie z rynku wadliwych serii wspomnianego produktu leczniczego, które zostały już dopuszczone do obrotu na terytorium Rzeczypospolitej Polskiej, a także zabezpieczenie rynku krajowego przed ewentualnym wprowadzeniem tych serii w przyszłości.